时间:2021-01-26 10:15:07 点击:次
目前生猪复养复产取得了可喜进展,生猪的存栏量不断提高,虽然我们经历了两年多的“抗非防非”严峻考验,积累了宝贵的生产实践经验和教训,但是非洲猪瘟的防控依然是头等大事。
非洲猪瘟病毒荧光PCR检测试剂盒,为疫情流调、监测、溯源以及“精准清除”提供了巨大的技术支持和物质保障,试剂盒的敏感性、特异性和稳定性,是备受关注的核心问题。为此,许多养殖企业不断开展试剂盒的比对评价实验。
鉴于前期发现一些比对实验在设计方面存在一定缺陷,因此现就有关比对实验注意事项建议如下:
第一步 准 备
01 参加比对实验的试剂盒
比对前,应与试剂盒生产厂家进行沟通,充分了解其产品的性能和不同的应用场景,根据自身使用需求选择相应的试剂盒。为获得试剂盒的真实数据,应利用6~12个月的时间,从流通渠道采购相应品种不同时间生产的不同批次,每个批次3~5盒,按保存条件要求进行保存。收集足够的试剂盒,用于后续比对实验。
从流通环节采购试剂盒,比让生产厂家直接提供,更能够实现比对实验的目的。
02 比对实验的操作人
要求经验丰富、技术水平较高的长期(一年以上)从事荧光PCR检测工作的技术人员2~3人。
03 标准品或样品
可以选用
1)病毒基因组标准物质;
2)质粒标准物质(含ASFV P72基因全长);
3)假病毒标准物质;
4)灭活的多类型的临床样品。


病毒基因组和质粒标准物质非常纯净,不含杂质,不能形成基质效应,难以评价试剂盒的耐受性和适应性,可以用于试剂盒最低检出限的比对,验证试剂盒中引物探针的设计和酶反应体系的扩增效率。
假病毒和灭活的临床样品含有不同类型和浓度的杂质,存在基质效应,可以用于试剂盒的敏感性比对和最低检出限比对。也可使用某些厂家的阳性对照质粒进行试剂盒最低检出限的比对,但是必须确认该质粒P72基因为全长。
04 对比实验所用的仪器
因比对实验反应数量较多,尽量选用96、48或32孔荧光PCR仪;实验室所在地有大功率用电设备,应单独为PCR仪加装稳压器。
05 系统性验证
对人员、PCR仪、移液器、耗材及实验室环境和操作规程,进行全面验证。
尤其是荧光PCR仪,选用任意一种厂家同一批次的试剂盒,用同一个中阳性样品(Ct值30~35左右),一次性进行96、48或32全孔反应,确保每个加热槽的加热、降温、扩增、信号采集性能基本一致。
有条件的实验室可选用荧光PCR校准试剂盒对PCR仪进行验证。一旦出现异常情况应进行排查,确保后续的比对实验完全可控。
第二步 检 测
01 最低检出限比对
采用质粒、病毒基因组标准物质或者假病毒标准物质,首先进行10倍系列稀释,制备3~5梯度,最高稀释度为每个PCR反应加样量含10拷贝左右的靶序列,即配即用。然后对所保存各厂家3个以上批次的成品试剂盒进行比对,每个稀释梯度,至少重复3~8个反应。
一般情况下其Ct值超过35时,应统计出现Ct的反应数即检出率,进行比较。同样的样品,先比较检出率,再比较平均Ct值;检出率越高,平均Ct值越小,最低检出限越低,检测的灵敏度就越高。
02 敏感性比对
采用假病毒或多类型的临床样品。假病毒可以进行10倍系列稀释,来源充足,溶液均一,质量稳定可控,即配即用。使用临床样品时,应将不同来源的样品如唾液、血液、血清、粪便、组织匀浆液等,灭活后按类型进行合并、混匀、离心取上清液,确保每一类样品浓度均一,体积数量应超过5ml。
先用任一种试剂盒,对不同类型的临床样品进行初步检测,确保各类型样品的Ct值分布在30~40之间,然后进行分装,冷冻保存。使用时,用一支,取一支,弃一支,避免反复冻融,避免长时间冷藏保存,造成实验误差,不能完全反应试剂盒的性能。
统一采用同一种方法,磁珠法或离心柱式提取后的样品核酸,对所保存同一厂3个以上批次的成品试剂盒进行比对,每个样品重复3~8个反应,必要时可做20个反应。
一般情况下Ct值超过35的样品,统计出现Ct的反应数即检出率,进行比较。同样的样品,先比较检出率,再比较检测平均Ct值;检出率越高,Ct值越小,试剂盒的敏感性越强。
03 稳定性比对
对不同厂家的各个批试剂盒的最低检出限比对实验中各浓度样品的检测数据、敏感性比对实验中各样品的检测数据进行分类统计分析。
计算同一样品用不同批次试剂盒检测Ct值之间的变异系数;计算不同样品不同批次试剂盒检测数据之间的总变异系数。变异系数越小,试剂盒的批间差异越小,性能越稳定。
04 例外提醒
极个别厂家的试剂盒设计的反应程序,不是从第一个循环开始收集荧光信号,计算Ct值时显著低于主流设计试剂盒,此类试剂盒的Ct值没有可比性,仅比较检出率。
第三步 分 析
01 最低检出限
标准物质系列稀释后,对同一样品检出的稀释倍数越大,相同稀释倍数的检出率越高,平均Ct值越小,则该试剂盒的最低检出限越低,检测灵敏度越高。
某种试剂盒的3个批次对假病毒标准物质(特定浓度)的3个稀释度20000、40000、80000倍,各进行20个反应的检出率和检测平均Ct值。
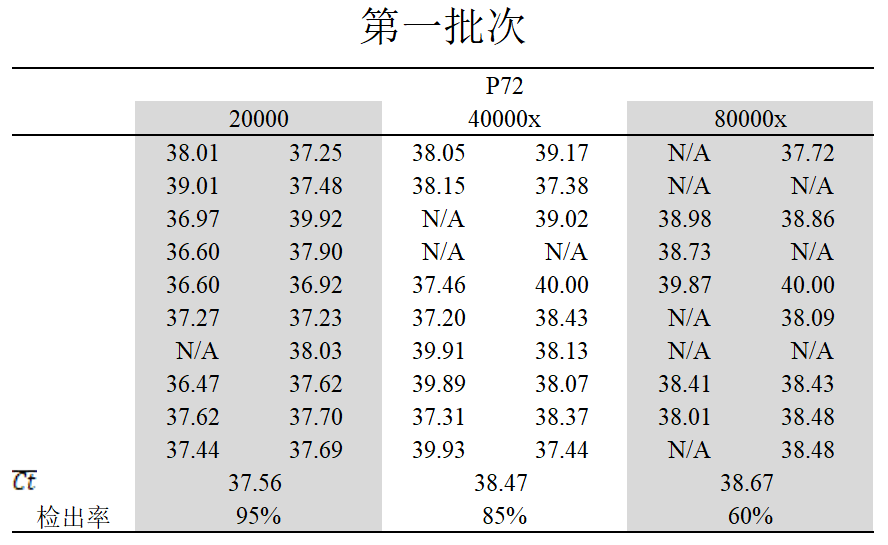
第一批
对20000倍检出率95%,平均Ct值为37.56,
对40000倍检出率85%,平均Ct值为38.47;
对80000倍检出率60%,平均Ct值为38.67。
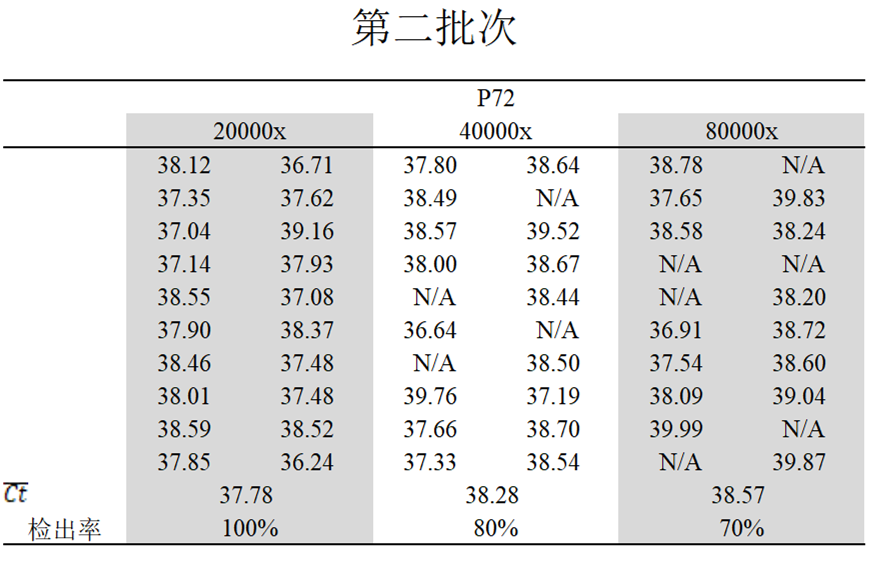
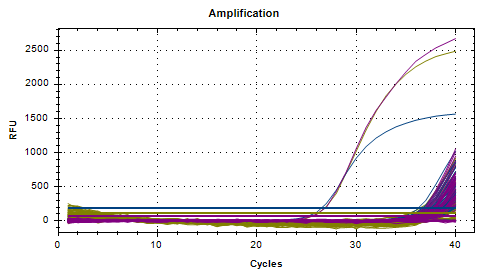
第二批
对20000倍检出率100%,平均Ct值为37.78,
对40000倍检出率80%,平均Ct值为38.28;
对80000倍检出率70%,平均Ct值为38.57。
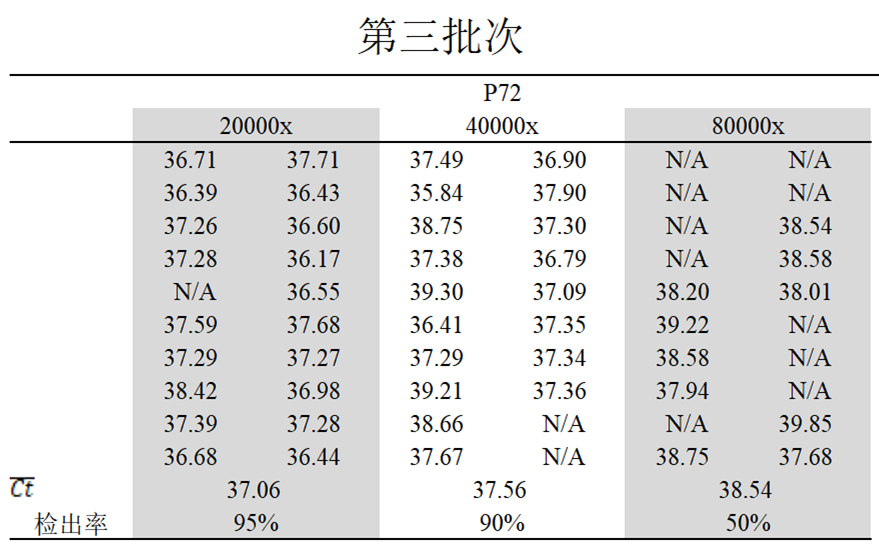
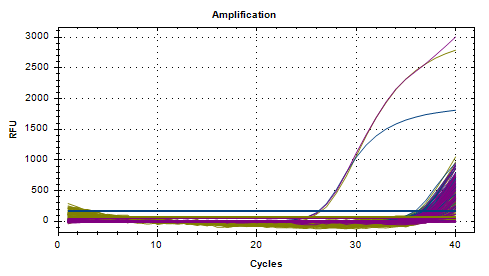
第三批
对20000倍检出率95%,平均Ct值为37.06,
对40000倍检出率90%,平均Ct值为37.56;
对80000倍检出率50%,平均Ct值为38.54。
02 敏感性实验数据分析
敏感性实验数据分析分析各厂家试剂盒不同批次间的稳定性时,可对同样的临床样品或者标准物质,不同批次间的检测Ct值应计算变异系数即CV值。
CV值一般情况下应小于5%,甚至可以小于2%,数据越小,批次间的差异越小,试剂盒的质量越稳定。
某种试剂盒连续14个批次留样,2人用3个样品、同一台荧光PCR仪进行的批间差异检验。分别按人、按样品进行批间变异系数分析,结果14批试剂盒:
对样品ASFV/B1/1检测平均Ct值为29.71,CV值为1.24%;
对样品ASFV/B1/2检测平均Ct值为32.28,CV值为1.15%;
对样品ASFV/B1/3检测平均Ct值为35.46,CV值为1.70%。
14批试剂盒对3个样品的2人实验,批间变异系数均小于2%,表明试剂盒稳定性极高。
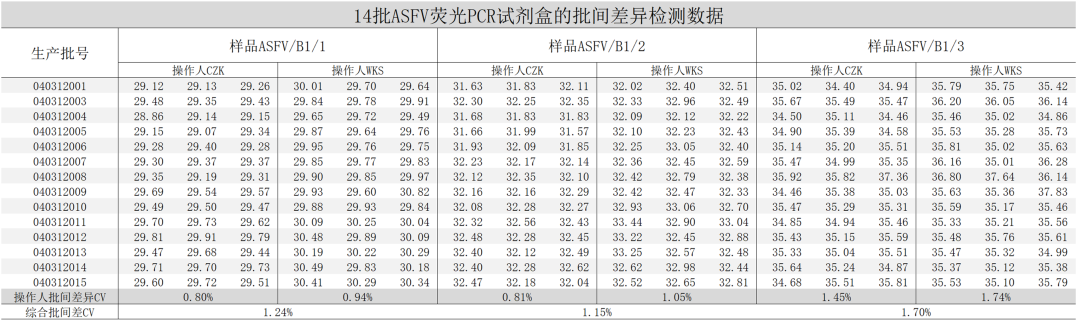
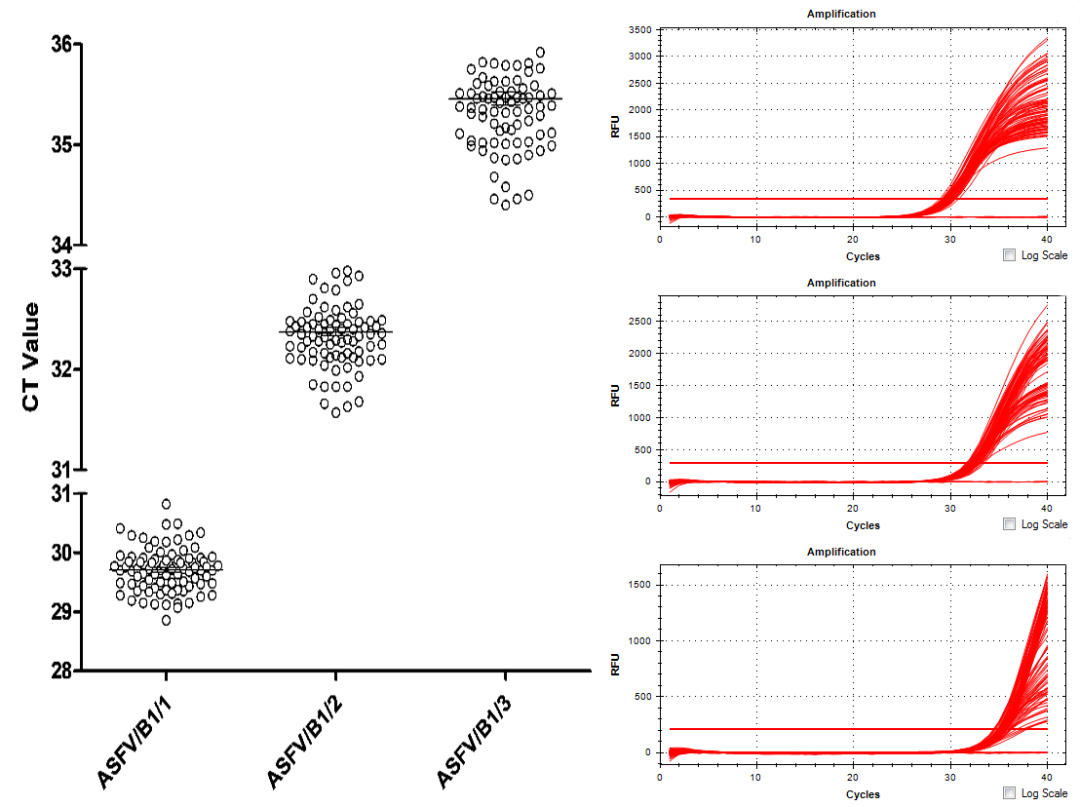
14个批次试剂盒2人3样品荧光PCR扩增曲线图和Ct值分布图
友情提示:
1、鉴于生产实践中的客观条件和适用性,删减了相对严谨的要求,简化了部分环节;对于CNAS认可实验室的设计,应进一步补充相关要求。
2、鉴于生产实践要求,本文未设计特异性实验比对。
3、其他类型的核酸检测试剂盒的最低检出限、敏感性和稳定性比对实验设计可以参考本方案。
END

关注兽医诊断制品 | 获取更多行业咨询
Copyright © 2012-2022 青岛立见生物科技有限公司版权所有 备案号: 信息公示
技术支持:微动力网络